近日,中国热科院椰子所植物保护研究室团队在槟榔黄化病原植原体检测技术方面取得新进展。该团队基于植原体16S rDNA基因序列保守区设计了特异性的外引物以及内引物,在优化后的反应体系与扩增条件下,阳性样品可扩增到大小为429 bp的特异性单一目的条带。新研发的方法具有准确、特异性强、灵敏度较高的特点,可为槟榔黄化病的及时诊断及早期防控提供技术支撑。
由植原体引起的槟榔黄化病是一种致死性病害,该病已严重威胁海南槟榔产业可持续发展。目前,科研人员针对植原体已建立了多种分子检测方法,如巢式PCR、环介导等温扩增LAMP、实时荧光定量PCR(qPCR)以及微滴式数字PCR(ddPCR)。上述方法均有其优点,但也各有不足之处。例如,LAMP方法可在恒温条件下检测,但实验操作过程中易污染,容易出现假阳性结果;qPCR和ddPCR灵敏度高,但所用试剂成本较高,对实验操作环境要求更为严苛,且仪器设备昂贵。更重要的是,上述3种检测方法的扩增产物无法测序和进一步分析。相比而言,采用植原体通用引物组的巢式PCR检测方法假阳性率高,特异性较差,严重影响检测效率。然而,该方法的扩增产物可以进行测序,因此依然被广泛用于植原体检测和分类鉴定研究。
此前研究发现,应用通用引物组P1/P7 + R16mF2/R1或R16mF2/R1 + R16mF2n/R2的巢式PCR方法存在检出效率低的问题,后续基于新设计的引物组F4/R1 + F2/R2建立的巢式PCR方法效率较高但同样存在非特异性片段扩增的问题。为了解决应用已有巢式PCR引物组检测产生非特异性扩增的问题以及适应新病原16Sr II组槟榔黄化植原体的检测需求,该团队重新设计开发了由特异性引物HNP-1F/1R和HNP-2F/2R组成的巢式PCR检测体系,建立了海南槟榔黄化植原体(16SrI组及16SrII组)巢式PCR特异性检测方法,针对16SrI组和16SrII组植原体的灵敏度最低检测限度分别为750 ag/μL和4 pg/μL。本研究可为后续槟榔种苗、田间病株的病原检测、鉴定及病害早期防控提供技术支撑。
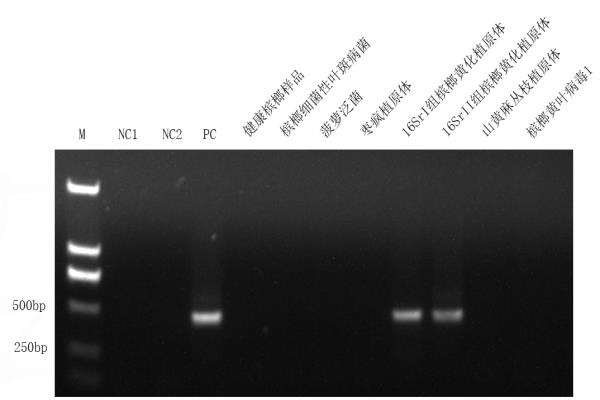
图1 应用新研发的巢式PCR方法特异性验证电泳图谱
相关研究成果以“Specific Nested PCR for the Detection of 16SrI and 16SrII Group Phytoplasmas Associated with Yellow Leaf Disease of Areca Palm in Hainan, China”为题发表于中科院分区二区期刊《Plants》(影响因子4.1)。中国农业大学与椰子所联培研究生葛慧远为论文第一作者,椰子所唐庆华副研究员和中国农业大学朱小琼副教授为论文共同通讯作者,该研究依托西北农林大学康振生院士团队创新中心平台,得到了海南省重大科技计划、重点研发等项目的资助。
论文链接:https://doi.org/10.3390/plants14142144
 1960年2月周恩来总理视察热作两院(华南热带作物科学研究院和华南热带作物学院的简称)时,了解到椰子树是一种多年生木本高产油料作物,一个成熟的椰子果实可以榨出二两油,心里总是装着人民的周总理指示“椰子的科学...
查看详情»
1960年2月周恩来总理视察热作两院(华南热带作物科学研究院和华南热带作物学院的简称)时,了解到椰子树是一种多年生木本高产油料作物,一个成熟的椰子果实可以榨出二两油,心里总是装着人民的周总理指示“椰子的科学...
查看详情»








